Klinische Gefässforschung
Gefässe verbinden unseren gesamten Körper. So begreifen wir auch unsere Forschung: Seit mittlerweile zwei Jahrzehnten verfolgt unsere Arbeitsgruppe diesen integrativen Gedankenansatz weiter.
«Der Mensch ist so alt wie seine Gefässe.» (R. Virchow, 1821–1902)

Forschungsteam Klinische Gefässforschung (v.l.n.r.): Dr. Thomas Haider, Dr. Delia Nebunu, Dr. Leonie Kreysing, Prof. Dr. Andreas Flammer, Anne-Marieke Vegter, Dr. Matthias Nägele, Prof. Dr. Isabella Sudano, Dr. Sander Trenson.
Gefässe vernetzen Herz, Hirn und Hand
Wir betrachten das Herz nicht als isolierte Struktur, sondern als überlebenswichtigen Teamplayer in einem komplexen Netzwerk von Gefässen, welches den gesamten Körper durchspannt und alle Organe miteinander verbindet. Klinische Forschung bedeutet für uns immer im Herzen Teamarbeit: Herzinsuffizienz- und Präventionsspezialisten arbeiten dabei eng mit Studienkoordinatoren und Postdocs zusammen und dies über die Disziplinen der Physiologie, Endokrinologie, Rheumatologie, Ophthalmologie und Neurologie hinweg.
Das wichtigste Anliegen unseres interdisziplinären klinischen Forschungsteams bleibt aber das gute und professionelle Verhältnis zu unseren Patienten und Patientinnen. Unsere Probanden und Probandinnen vertrauen auf eine gute Behandlung in jeder Hinsicht. Ihre Bereitwilligkeit an Studien teilzunehmen, welche Gefässfunktionsmessungen, Abgabe von Daten, Biomaterial und die Randomisierung zu innovative Therapien beinhalten, ermöglichen uns relevante Antworten auf offene wissenschaftliche Fragestellungen zu finden — oder neue Fragen auf zu werfen.
Das flächenmässig ‘fussballfeldgrosse’ Organ Endothel, welches alle unsere Gefässe von innen auskleidet, ist dabei das zentrale Objekt unserer Forschung. Menschen haben grosse Gefässe (Makrogefässe), wie zum Beispiel die Armarterie (A. brachialis) und sehr kleine Gefässe (Mikrogefässe), wie zum Beispiel die Gefässe im Augenhintergrund (retinale Gefässe). Der Kern unserer Forschung ist, Goldstandardmethoden der Gefässfunktionsmessung mit neuen und innovativen Untersuchungsansätzen zu kombinieren. Damit erschliessen sich für uns neue Blickwinkeln auf die verschiedenen Abschnitte unseres Gefässbettes und wir können somit ihre Rolle in Bezug auf Gesundheit, Risiko, Krankheit und Therapie erkunden.
Messung der Gefässfunktion
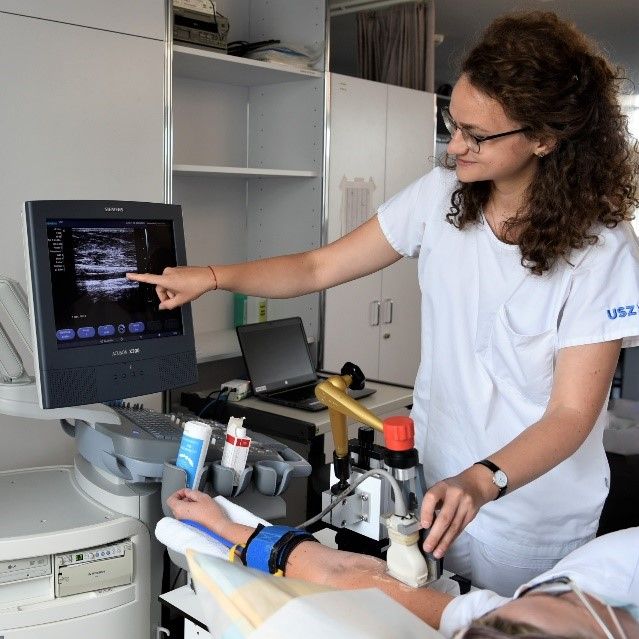
Die Endothelfunktion kann heute auf mehreren Wegen klinisch untersucht werden und ist mittlerweile ein potentiell wichtiger Parameter zur Früherkennung von arteriosklerotischen Gefässveränderungen und zur Abschätzung des Risikos für spätere Herzkreislauferkrankungen geworden. Die Messung der endothelabhängigen Gefässerweiterung (Vasodilatation) kann dabei invasiv und nicht-invasiv erfolgen. Zu den invasiven Methoden gehören zum Beispiel die intrakoronare Infusion von Acetylcholin mit anschliessender quantitativer Koronarangiographie. Praktisches Potential ausserhalb des Katheterlabors haben vor allem die nicht-invasiven Methoden: Flussabhängige Vasodilatation (Flow-mediated Dilatation, FMD) der A. brachialis (Abb. 2) , Haut-Mikrozirkulation mittels Doppler-Laser und insbesondere die retinale Gefässanalyse (Retinal Vessel Analysis, RVA, Abb. 1.).
Strukturell beurteilen wir Gefässe z.B. mit Pulswellenanalyse (PWA; Abb.3) als Mass für arterielle Steifigkeit und mit der Augenhintergrundbeurteilung im Rahmen der RVA (arterio-venöses Gefässverhältnis, AVR). Auch die sonographische Beurteilung der Intima-Media-Dicke der Halsschlagadern wird zur umfassenden Phänotypisierung der Gefässfunktion benutzt.

Das Auge als Fenster zum Herzen
Die dynamische retinale Gefässanalyse der RVA erlaubt uns völlig neue Einblicke auf fast schon verblüffend einfache Art und Weise: das Auge als Fenster zum Herzen (Abb. 4).
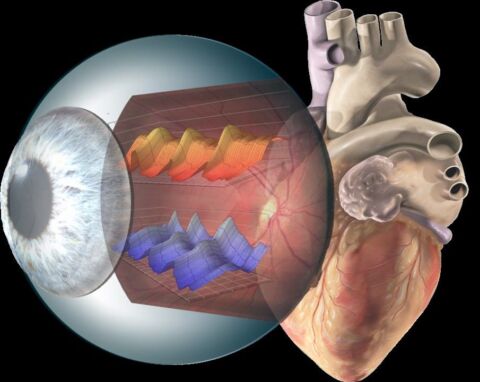
Abb. 4: Illustration dynamische retinale Gefässanalyse.
Die Methode basiert auf hochauflösenden Videoaufnahmen mit computerbasierter Ausmessung der Blutgefässe des Augenhintergrundes vor und nach der Anwendung von Flickerlicht. Durch das Flickerlicht erhöht sich der Sauerstoffbedarf der Netzhaut, welcher durch Erweiterung der zugehörigen Gefässe kompensiert wird. Diese Erweiterung wird zu einem grossen Teil durch Stickstoffmonoxid (NO) vermittelt, ein zentraler Botenstoff von gesunden Endothelzellen. Eine unzureichende Erweiterung der Netzhautgefässe ist somit ein Zeichen einer endothelialen Dysfunktion der kleinen Gefässe (mikrovaskuläre Dysfunktion).
Aktuell nutzt das Forschungsteam Klinische Gefässforschung die DVA zur Erforschung der Endothelfunktion bei Herzinsuffizienz und bei klassischen Risikofaktoren. In einer Beobachtungsstudie werden so die Endothelfunktion in den kleinen Gefässen im Auge mit der Endothelfunktion am Oberarm sowie der Gefässsteifigkeit bei Patienten mit Herzschwäche, Probanden mit kardiovaskulären Risikofaktoren und gesunden Kontrollen verglichen. Wir konnten erstmals die mikrovaskuläre Schädigung bei Herzschwäche anhand der dynamischen Funktionsanalyse von Netzhautgefässen zeigen und hochrangig publizieren (Nagele, Barthelmes et al. 2018). Als wichtigen Risikofaktor, welcher zu einer mikrovaskulären Dysfunktion führen kann, konnten wir die Hypercholesterinämie identifizieren (Nagele, Barthelmes et al. 2018). Es zeigte sich ausserdem, dass in der Progression der koronaren Herzkrankheit zur ischämischen Kardiomyopathie die retinale mikrovaskuläre Dysfunktion progredient zunimmt (Barthelmes, Nagele et al. 2019). Somit spiegelt die retinale Gefässfunktion das Kontinuum des progredienten vaskulären Schadens wider. Hierdurch könnte die Methode sowohl für die Charakterisierung unterschiedlicher Herzerkrankung, die initiale Risikostratifikation als auch zur Beurteilung des Therapieerfolges bei Patienten und Patientinnen mit kardiovaskulären Risikofaktoren oder Erkrankungen sehr hilfreich sein. Im Rahmen der laufenden Beobachtungsstudie schauen wir uns deswegen aktuell das Gefässprofil zum Beispiel von Herzschwäche-Patienten und -Patientinnen mit erhaltender systolischer Kammerfunktion (HFpEF) detailierter an.
Medikamente können die Gefässfunktion verbessern — oder verschlechtern
Ein Fokus der Forschungsgruppe ist die Testung der kardialen Sicherheit von häufig verschriebenen Medikamenten. Unter anderem untersucht wurde die Wirkung von Paracetamol, einem häufig verwendeten Schmerzmittel, auf Blutdruck und Endothelfunktion bei Patienten und Patientinnen mit koronarer Herzkrankheit. Dabei konnte nachgewiesen werden, dass Paracetamol nicht wie angenommen ohne Herzkreislauf-Nebenwirkungen ist, sondern den Blutdruck erhöhen kann (Sudano, Flammer et al. 2010). Des Weiteren wurden die Effekte von polyphenolreihen Substanzen (dunkle Schokolade, Pycnogenol) auf die Endothelfunktion bei Patienten und Patientinnen mit Herzinsuffizienz oder koronarer Herzkrankheit auf die Gefässfunktion untersucht. Wir konnten zeigen, dass sowohl Pycnogenol als auch schwarze Schokolade die Endothelfunktion bei diesen Patienten und Patientinnen verbessern kann und somit mutmasslich der Entstehung der Atherosklerose entgegenwirken kann (Flammer, Hermann et al. 2007).
Aktuell beschäftigt sich das Team mit der Rolle der Endothelfunktion als potentiellen Marker für den Erfolg neuer Herzinsuffizienztherapien. Wir untersuchen in diesem Zusammenhang aktuell die Gefässfunktion unter Valsartan/Sacubtril (Entresto®) gegenüber Valsartan allein (VASCEND-LCZ). Eine Empfehlung für Valsartan/Sacubitril wurde aufgrund klarer Verbesserung der Prognose und Rehospitalisationsrate bereits in die Leitlinien aufgenommen. Wir helfen zu erklären, weshalb Valsartan/Sacubitril so vielversprechend wirkt. Neben neuen Medikamenten kommen in der modernen Medizin vermehrt nicht-medikamentöse Therapien zum Einsatz. So kann sich durch eine kardiale Resynchronizationstherapie (CRT) eine Herzschwäche wieder deutlich bessern. Die Unterstützung durch den SNF ermöglicht uns, den Effekt dieser kardialen Resynchronizationstherapie auf die Gefässfunktion genauer zu untersuchen.
Neben der Gefässfunktion steht in einem weiteren, vom SNF unterstützten-Projekt die sympathische Nervenaktivität im Mittelpunkt. Ziel der Studie OPIOVASC ist es, den vaskulären und sympathikotonen Effekt von Opioiden und nicht-steroidalen Anti-Rheumatika (NSAIDs) in Patienten und Patientinnen mit Osteoarthritis im Vergleich zu Gesunden zu untersuchen. Diese Kombination an Messmethoden haben wir bereits in vorangegangen Studien angewandt. So konnten wir zeigen, dass Patienten und Patientinnen mit Takotsubo Syndrom eine beeinträchtigte Endothelfunktion und eine erhöhte Aktivität des sympathischen Sympathikus-Nervensystems im Vergleich zur Kontrollgruppe aufwiesen. Diese Studie unterstreicht die möglicherweise zentrale Rolle von Stress und Stressverarbeitung bei der Entstehung dieser Erkrankung (Naegele, Flammer et al. 2016).
Gegen Stress hilft Schokolade—dunkle Schokolade. Nachdem unsere Ergebnisse zum Nutzen dunkler Schokolade auf die Gefässfunktion (Flammer, Hermann et al. 2007) unter einiger medialer Aufmerksamkeit publiziert wurde, setzen wir die Untersuchung von polyphenolartigen Substanzen aktuell in einer Katheterstudie fort. Wir testen den Effekt eines Flavonoid-Getränks (enthalten in dunkler Schokolade) auf die Herzkranzgefässe bei bereits herzkranken Patienten und Patientinnen.
Blutvolumen als wichtiges Bindeglied des Herzkreislaufsystem
Blut ist das Transportmedium innerhalb des Gefässnetzwerks unseres Körpers und transportiert den lebenswichtigen Sauerstoff, Nähr- und Botenstoffen (Hormone) aber auch Stoffwechselendprodukte sowie Zellen des Immunsystems und der Gerinnung. Das Blutvolumen eines Menschen beträgt im Durchschnitt ca. 5 Liter. Es setzt sich zu ca. 60% aus Flüssigkeit, dem Blutplasma, und zu ca. 40% aus festen Bestandteilen, vor allem Blutzellen, zusammen. Es wird von unterschiedlichen Organen und Hormonsystemen wie etwa dem Renin-Angiotensin-Aldosteron-System (RAAS) reguliert. Erkrankungen des Herzkreislaufsystems wie etwa die Herzschwäche können zu einem pathologisch veränderten Blutvolumenstatus führen. Eine Volumenüberlast (Hypervolämie) ist der häufigste Grund für eine Dekompensation des Herzkreislaufsystems bei Herzschwäche und führt nicht selten zu einer Hospitalisierung und dem Einsatz von entwässernden Medikamenten (Diuretika). Umgekehrt wird die Blutarmut (Anämie), eine Verminderung der roten Blutzellmasse, relativ häufig bei Herzschwäche beobachtet. Eine Anämie ist dabei mit einem erhöhten Krankheitsrisiko und einer erhöhten Sterblichkeit verbunden. Der Erhaltung eines physiologischen Blutvolumens (Euvolämie) kommt somit eine zentrale Bedeutung in der Therapie der Herzinsuffizienz zu. Indirekte Methoden zur Bestimmung des Volumenstatus wie etwa klinische Zeichen einer Volumenüberlast (z.B. Halsvenenstauungszeichen) sind diesbezüglich relativ ungenau und unspezifisch. Deshalb spielt die exakte und zuverlässige Bestimmung des Blutvolumens anhand von quantitativen Messmethoden eine essentielle Rolle. Die Messung des Blutvolumens mit Hilfe der Kohlenmonoxid-Rückatmungsmethode (CORB, Abb. 5) ist dabei eine nicht-invasive, sichere und einfach anwendbare Methode zur Bestimmung des Blutvolumens sowie dessen Komponenten (z.B. Plasmavolumen, totale Hämoglobinmasse, rotes Blutzellvolumen). Mit Hilfe dieser Methode konnten wir kürzlich zeigen, dass Herzschwäche-Patienten und -Patientinnen mit einer erhaltenen Auswurfleistung der linken Herzkammer (HFpEF) ein reduziertes Blutvolumen im Vergleich zu gleichaltrigen gesunden Personen aufweisen können, was sich unter anderem in einer erhöhten Aktivität der Blutvolumen-regulierenden Hormonsysteme wiederspiegelte (Montero, Haider et al. 2019). Das reduzierte Blutvolumen war dabei auf ein verringertes rotes Blutzellvolumen (RBCV) zurückzuführen, das zu einer reduzierten Sauerstofftransportkapazität mit eingeschränkter körperlicher Leistungsfähigkeit beitragen kann. In einer weiteren Vergleichsstudie konnten wir zudem zeigen, dass bereits eine einzelne Hämodialyse-Sitzung zu einer veränderten Antwort der kleinen Gefässe des Augenhintergrunds (v.a. der Venulen) auf Flickerlicht führt (Montero, Haider et al. 2020). Aktuell untersuchen wir in einer prospektiven Observationsstudie (BLOVO-CVD1) den Blutvolumenstatus und dessen Rolle hinsichtlich Gefässfunktion bei Herzschwäche-Patienten und -Patientinnen im Vergleich zu Patienten und Patientinnen mit kardiovaskulären Risikofaktoren und gesunden gleichaltrigen Personen. Ferner untersuchen wir die Rolle des Blutvolumens bei Patienten und Patientinnen mit therapieresistentem Bluthochdruck im Rahmen eines disziplinübergreifenden Kollaborationsprojekts (HYRENE). Zukünftig wollen wir auch verstärkt den Blutvolumenstatus bei akuter Herzinsuffizienz evaluieren mit der ambitionierten Zielsetzung, die Blutvolumenmessung zur Bestimmung des aktuellen Volumenstatus sowie zur Überwachung und Steuerung der Entwässerungstherapie in der klinischen Routine der Herzinsuffizienz zu etablieren. Zusätzlich werden wir auch im Zuge des DAPA-VOLVO-Projekts die Auswirkungen von neuen volumenregulierenden Medikamenten wie etwa die SGLT2-Inhibitoren auf den Volumen- sowie Gefässstatus bei klinisch stabilisierten Herzinsuffizienz-Patienten und -Patientinnen nach einer akut dekompensierten Herzinsuffizienz (ADHF) untersuchen.
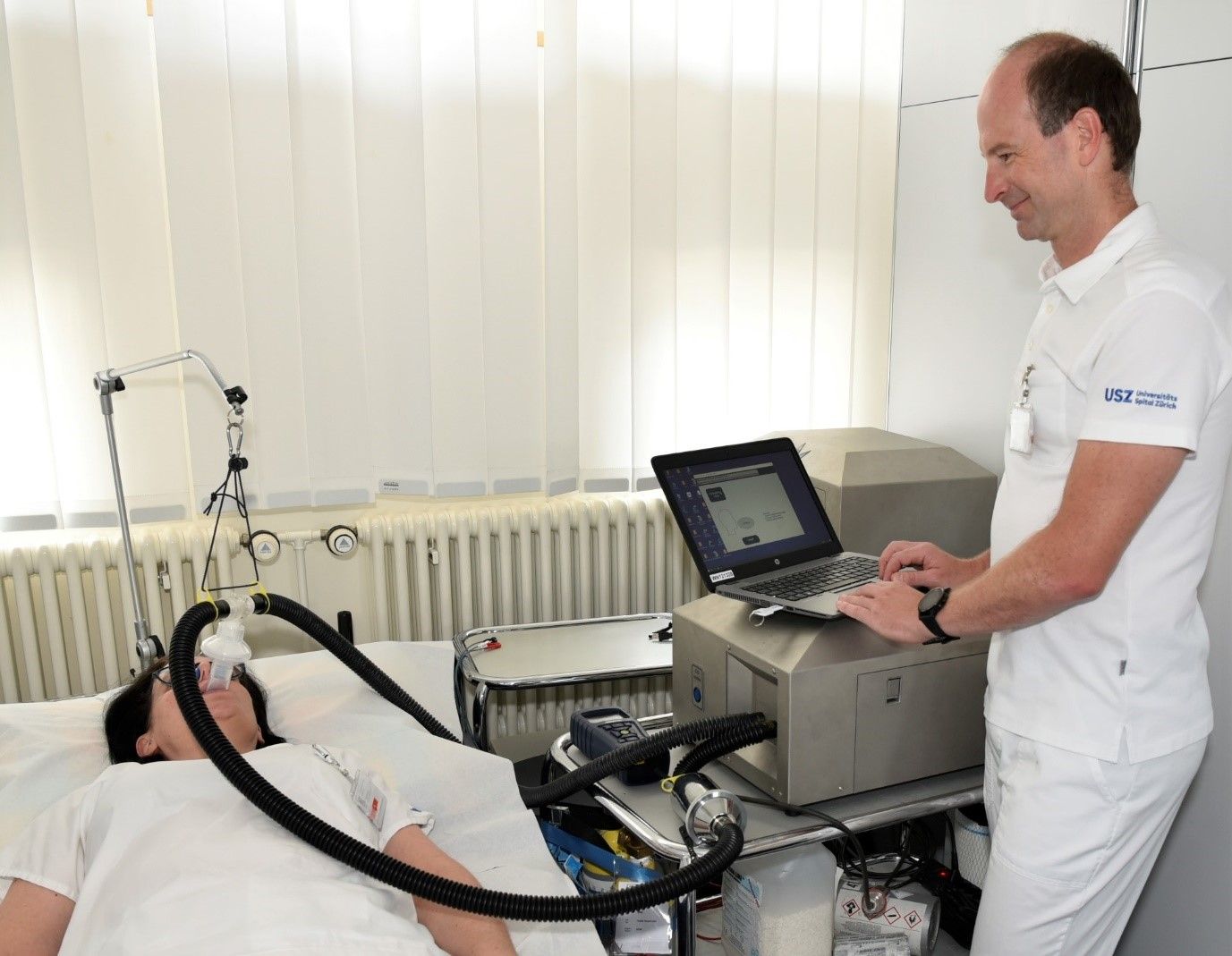
Abb. 5: Nicht-invasive Messung des Blutvolumens mit Hilfe der Kohlenmonoxid-Rückatmungsmethode (CO-RB) und dem Einsatz eines vollautomatisierten Messgeräts (OpCO, Detalo Health).
- Barthelmes, J., M. P. Nagele, S. Cantatore, E. Novruzov, V. Ludovici, A. von Eckardstein, M. Frank, F. Ruschitzka, I. Sudano and A. J. Flammer (2019). „Retinal microvascular dysfunction in patients with coronary artery disease with and without heart failure: a continuum?“ Eur J Heart Fail 21(8): 988-997.
- Flammer, A. J., F. Hermann, I. Sudano, L. Spieker, M. Hermann, K. A. Cooper, M. Serafini, T. F. Luscher, F. Ruschitzka, G. Noll and R. Corti (2007). „Dark chocolate improves coronary vasomotion and reduces platelet reactivity.“ Circulation 116(21): 2376-2382.
- Montero, D., T. Haider, J. Barthelmes, J. P. Goetze, S. Cantatore, I. Sudano, F. Ruschitzka and A. J. Flammer (2019). „Hypovolemia and reduced hemoglobin mass in patients with heart failure and preserved ejection fraction.“ Physiol Rep 7(21): e14222.
- Montero, D., T. Haider, M. P. Nagele, J. Barthelmes, S. Cantatore, I. Sudano, F. Ruschitzka, M. Bonani and A. J. Flammer (2020). „Effects of hemodialysis on blood volume, macro- and microvascular function.“ Microvasc Res 129: 103958.
- Naegele, M., A. J. Flammer, F. Enseleit, S. Roas, M. Frank, A. Hirt, P. Kaiser, S. Cantatore, C. Templin, G. Frohlich, M. Romanens, T. F. Luscher, F. Ruschitzka, G. Noll and I. Sudano (2016). „Endothelial function and sympathetic nervous system activity in patients with Takotsubo syndrome.“ Int J Cardiol 224: 226-230.
- Nagele, M. P., J. Barthelmes, V. Ludovici, S. Cantatore, M. Frank, F. Ruschitzka, A. J. Flammer and I. Sudano (2018). „Retinal microvascular dysfunction in hypercholesterolemia.“ J Clin Lipidol 12(6): 1523-1531 e1522.
- Nagele, M. P., J. Barthelmes, V. Ludovici, S. Cantatore, A. von Eckardstein, F. Enseleit, T. F. Luscher, F. Ruschitzka, I. Sudano and A. J. Flammer (2018). „Retinal microvascular dysfunction in heart failure.“ Eur Heart J 39(1): 47-56.
- Sudano, I., A. J. Flammer, D. Periat, F. Enseleit, M. Hermann, M. Wolfrum, A. Hirt, P. Kaiser, D. Hurlimann, M. Neidhart, S. Gay, J. Holzmeister, J. Nussberger, P. Mocharla, U. Landmesser, S. R. Haile, R. Corti, P. M. Vanhoutte, T. F. Luscher, G. Noll and F. Ruschitzka (2010). „Acetaminophen increases blood pressure in patients with coronary artery disease.“ Circulation 122(18): 1789-1796.